O câncer de mama triplo-negativo (TNBC) é uma das formas mais agressivas e difíceis de tratar do câncer de mama, mas um novo estudo liderado pela Weill Cornell Medicine sugere uma maneira surpreendente de impedir sua disseminação. Pesquisadores descobriram que uma enzima chamada EZH2 impulsiona as células TNBC a se dividirem de maneira anormal, permitindo que se redistribuam para órgãos distantes. O estudo pré-clínico também revelou que medicamentos que bloqueiam a EZH2 poderiam restaurar a ordem na divisão celular e impedir a propagação das células TNBC.
“A metástase é a principal razão pela qual os pacientes com câncer de mama triplo-negativo enfrentam baixas chances de sobrevivência,” disse o autor sênior, Dr. Vivek Mittal, Professor de Pesquisa Ford-Isom em Cirurgia Cardiotorácica e membro do Sandra and Edward Meyer Cancer Center na Weill Cornell Medicine. “Nosso estudo sugere uma nova abordagem terapêutica para bloquear a metástase antes que comece e ajudar os pacientes a superar esse câncer mortal.”
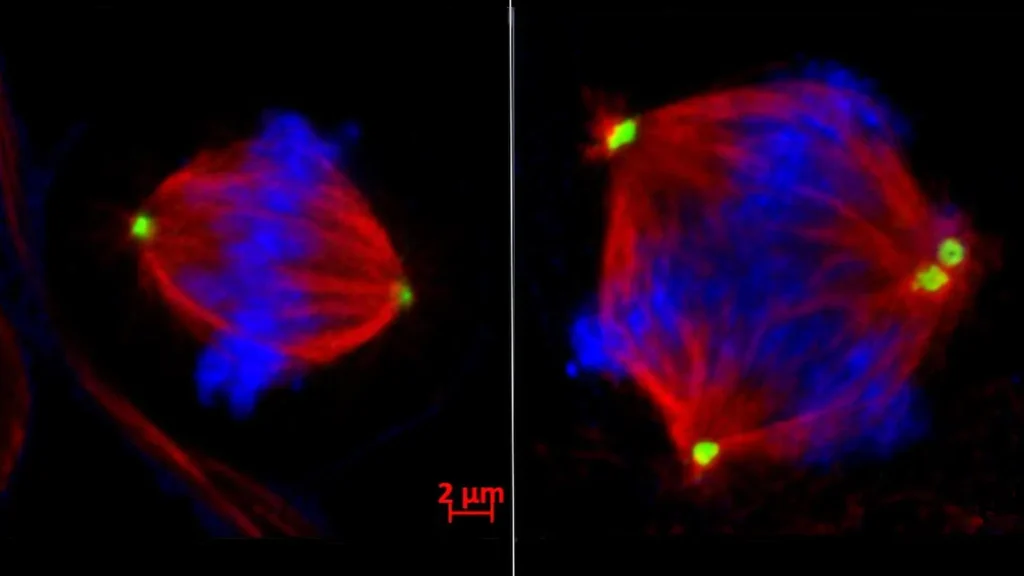
Os resultados, publicados em 2 de outubro na Cancer Discovery, desafiam a noção popular de que os tratamentos contra o câncer deveriam aumentar os erros de divisão celular já ocorrendo nas células tumorais além de um ponto crítico para induzir a morte celular. Quando células normais se dividem, os cromossomos — pacotes de DNA que transportam genes — são duplicados e divididos de maneira uniforme em duas células-filhas. Esse processo se descontrola em muitas células cancerígenas, levando à instabilidade cromossômica: excesso, falta ou cromossomos embaralhados em múltiplas células-filhas.
“Considero a tentativa de levar as células cancerígenas a um estado extremo de instabilidade cromossômica um pouco preocupante, pois se você não atingir o nível certo, isso pode, paradoxalmente, levar a uma doença mais agressiva,” disse o Dr. Mittal. “Em vez disso, nossos achados sugerem que restaurar a ordem na divisão celular, visando a EZH2, pode impedi-las de se espalharem.”
A autora principal, Dra. Shelley Yang Bai, começou esse trabalho enquanto era estudante de pós-graduação e agora é associada de pós-doutorado com o Dr. Mittal em cirurgia cardiotorácica na Weill Cornell Medicine. O Dr. Samuel Bakhoum, que estava no Memorial Sloan Kettering Cancer Center na época, co-liderou este estudo.
Conectando Epigenética e Metástase
Cerca de 5% das células em um tumor primário de TNBC têm alta propensão a metastatizar, e essas células apresentam características únicas, como metabolismo diferente, aumento da instabilidade cromossômica e epigenética alterada — modificações no DNA ou em suas proteínas associadas que não alteram diretamente o código genético.
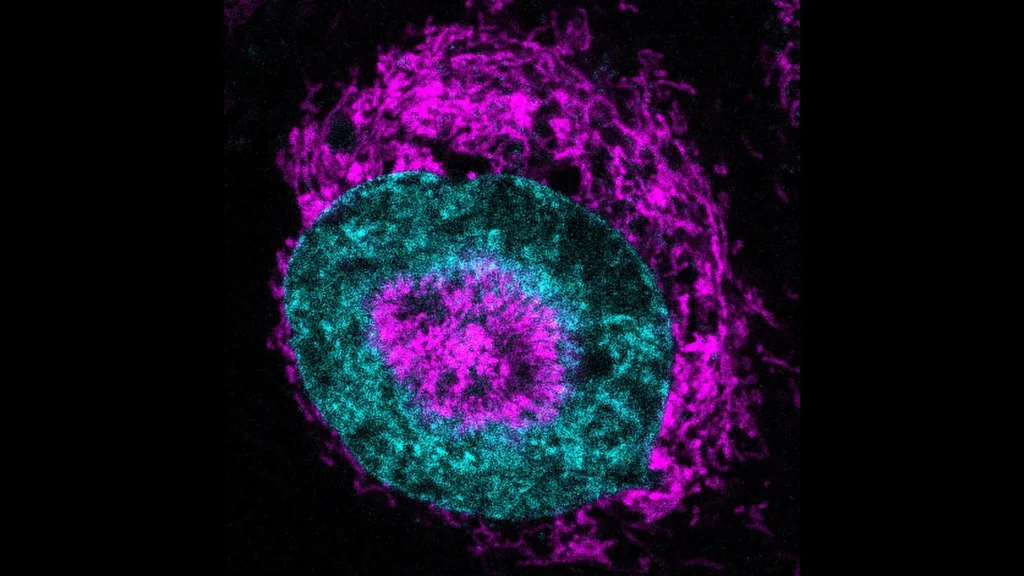
A equipe do Dr. Mittal encontrou um suspeito que pode estar provocando metástase nessas células cancerígenas específicas: a EZH2. Esta proteína normalmente modifica como o DNA é empacotado nas células. Mas os cânceres frequentemente sequestram a EZH2 aumentando sua produção. No TNBC, essa superprodução leva ao silenciamento de genes essenciais para a segregação correta dos cromossomos durante a divisão celular e a erros desenfreados.
Ao analisar dados de pacientes com câncer de mama, a Dra. Bai descobriu que pacientes com níveis mais altos de EZH2 também apresentavam células tumorais com mais alterações cromossômicas. Isso forneceu pistas para novos experimentos em laboratório. Enquanto a inibição da EZH2 com tazemetostat, um medicamento aprovado pela FDA para tratar certos cânceres, reduziu a instabilidade cromossômica em linhagens celulares, o aumento dos níveis de EZH2 por meio de manipulação genética aumentou os erros na divisão celular.
Além disso, modelos em camundongos com EZH2 elevado e instabilidade cromossômica em tumores primários mostraram metástases pulmonares aumentadas em comparação com tumores sem EZH2, confirmando um vínculo direto entre os níveis de EZH2, instabilidade cromossômica e metástase. Mas como a EZH2 estava causando a instabilidade?
Caos Cromossômico
A equipe descobriu que a EZH2 silencia o gene tankyrase 1, que normalmente garante o funcionamento adequado da maquinaria de separação de cromossomos durante a divisão celular. Isso desencadeia uma reação em cadeia — a diminuição da tankyrase 1 causa um acúmulo excessivo de outra proteína chamada CPAP. Isso leva os centrômeros da célula — estruturas que puxam os cromossomos para longe uns dos outros — a se multiplicarem de maneira descontrolada, resultando em divisões defeituosas em três ou mais células-filhas.
A equipe demonstrou que inibir a EZH2 restaurou o equilíbrio, reduzindo significativamente a metástase em modelos pré-clínicos. “Pela primeira vez, ligamos a EZH2, que é um regulador epigenético, à instabilidade cromossômica de forma mecanicista,” disse a Dra. Bai.
Os inibidores de EZH2 podem ser os primeiros medicamentos capazes de suprimir diretamente a instabilidade cromossômica. “Este estudo oferece uma nova abordagem promissora para o tratamento do câncer de mama triplo-negativo, visando a raiz das metástases,” disse a Dra. Magdalena Plasilova, professora associada de cirurgia clínica (em nomeação pendente), cirurgiã oncologista no NewYork-Presbyterian/Weill Cornell Medical Center e autora do estudo. “Vejo em primeira mão o impacto devastador das metástases nos pacientes, e isso oferece esperança para melhores resultados e taxas de sobrevivência.”
Embora o Tazemetostat possa ser reaproveitado como tratamento para TNBC, outros medicamentos podem ter efeitos semelhantes ou melhores. “Nossa descoberta abre a porta para ensaios clínicos que testem os inibidores de EZH2 em câncer de mama de alto risco e potencialmente outros cânceres também marcados pela instabilidade cromossômica, como o adenocarcinoma pulmonar,” disse o Dr. Mittal, que também é membro do Englander Institute of Precision Medicine na Weill Cornell. Atualmente, ele está planejando colaborações para realizar testes de segurança em um ensaio clínico.