Células cancerígenas reagem imediatamente, com um impulso energético, ao serem fisicamente comprimidas, conforme um estudo publicado na revista Nature Communications. Esse aumento de energia é a primeira evidência de um mecanismo de defesa que auxilia as células na reparação de danos no DNA e na sobrevivência em ambientes densos do corpo humano.
As descobertas elucidam como as células cancerígenas conseguem navegar por obstáculos mecânicos complexos, como se locomover através de um microambiente tumoral, deslizar para dentro de vasos sanguíneos porosos ou resistir aos impactos na corrente sanguínea. A identificação desse mecanismo pode abrir caminho para novas estratégias que imobilizem as células cancerígenas antes que elas se disseminem.
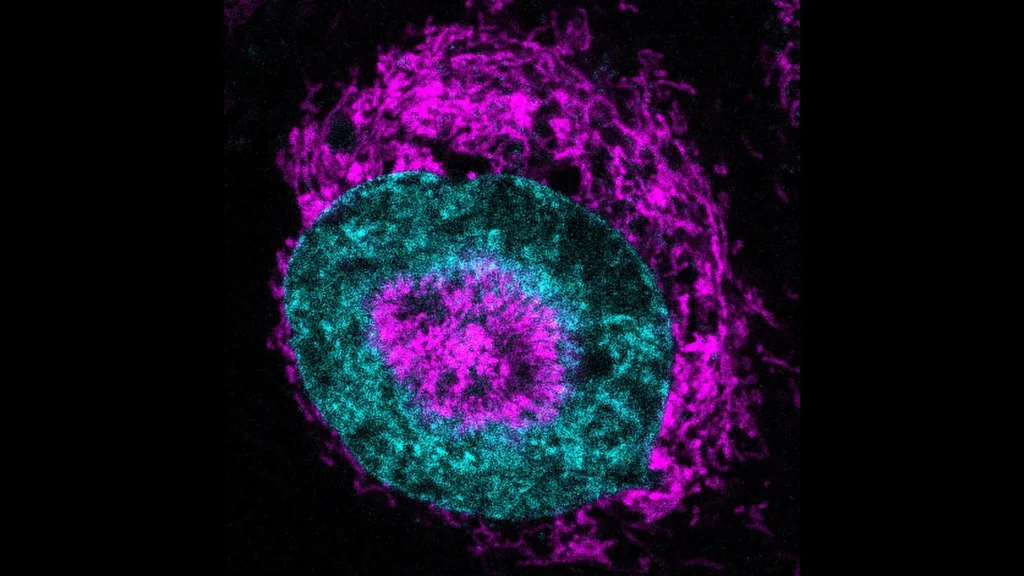
Pesquisadores do Centro de Regulamentação Genômica (CRG) em Barcelona realizaram a descoberta utilizando um microscópio especializado que comprime células vivas para apenas três micrômetros de largura, aproximadamente um trigésimo do diâmetro de um fio de cabelo humano. Eles observaram que, em questão de segundos após a compressão, as mitocôndrias nas células HeLA aceleram em direção à superfície do núcleo e injetam mais ATP, a fonte de energia molecular das células.
“Isso nos força a repensar o papel das mitocôndrias no corpo humano. Elas não são apenas baterias estáticas que energizam nossas células, mas sim como primeiros socorristas ágeis que podem ser acionados em situações de emergência quando as células estão literalmente sob pressão,” afirma a Dra. Sara Sdelci, co-autora correspondente do estudo.
As mitocôndrias formaram um halo tão apertado que o núcleo se deformou para dentro. Esse fenômeno foi observado em 84% das células HeLa comprimidas, comparado a praticamente nenhuma nas células flutuantes, não comprimidas. Os pesquisadores se referem a essas estruturas como “NAMs,” ou mitocôndrias associadas ao núcleo.
Para entender a função dos NAMs, os pesquisadores utilizaram um sensor fluorescente que acende quando o ATP entra no núcleo. O sinal aumentou cerca de 60% em três segundos após a compressão das células. “É um sinal claro de que as células estão se adaptando ao estresse e reconfigurando seu metabolismo,” explica o Dr. Fabio Pezzano, co-primeiro autor do estudo.
Experimentos subsequentes revelaram a importância do aumento de energia. A compressão mecânica estressa o DNA, rompendo cadeias e entrelaçando o genoma humano. As células dependem de equipes de reparo exigentes em ATP para desatar o DNA e alcançar locais danificados para consertar os estragos. Células comprimidas que receberam o impulso extra de ATP repararam o DNA em algumas horas, enquanto aquelas que não receberam, pararam de se dividir adequadamente.
Para verificar a relevância para a doença, os pesquisadores também analisaram biópsias de tumores da mama de 17 pacientes. Os halos NAM apareceram em 5,4% dos núcleos nas bordas tumorais invasivas, em contraste com 1,8% no núcleo mais denso do tumor, uma diferença de três vezes. “Ver essa assinatura em biópsias de pacientes confirmou a relevância além do experimento de laboratório,” explica o Dr. Ritobrata (Rito) Ghose, co-primeiro autor do estudo.
Os pesquisadores também puderam investigar a engenharia celular que torna possível a corrida mitocondrial. Filamentos de actina, as mesmas cabos proteicos que permitem que os músculos se flexionem, se agrupam ao redor do núcleo, enquanto o retículo endoplasmático forma uma rede semelhante a uma malha. O estudo mostra que a estrutura combinada fisicamente prende os NAMs no lugar, formando a estrutura em forma de halo. Quando os pesquisadores trataram as células com latrunculina A, um medicamento que desmantela a actina, a formação dos NAMs colapsou e a onda de ATP diminuiu.
Se as células metastáticas dependem dos aumentos de ATP impulsionados pelos NAMs, medicamentos que bloqueiam a estrutura poderiam tornar os tumores menos invasivos sem envenenar amplamente as mitocôndrias e preservar os tecidos saudáveis. “As respostas ao estresse mecânico são uma vulnerabilidade subexplorada das células cancerígenas que podem abrir novas avenidas terapêuticas,” diz a Dra. Verena Ruprecht, co-autora correspondente do estudo.
Embora o estudo tenha analisado células cancerígenas, os autores enfatizam que o fenômeno provavelmente seja universal na biologia. Células imunes passando por linfonodos, neurônios estendendo ramificações e células embrionárias durante a morfogênese experimentam forças físicas similares.
“Onde quer que as células estejam sob pressão, é provável que um impulso energético nuclear esteja protegendo a integridade do genoma,” conclui a Dra. Sdelci. “É uma nova camada completamente nova de regulação na biologia celular, marcando uma mudança fundamental em nossa compreensão de como as células sobrevivem a intensos períodos de estresse físico.”